Das Labor der Kathy Gould an der Vanderbilt University School of Medicine verwendeten einen multidisziplinären Ansatz, der Strukturbiologie, Biochemie und Molekularbiologie umfasste, um die Regulation der CK1-Enzymfamilie zu untersuchen. Die Forschung wurde in der Zeitschrift veröffentlicht Molekulare Zelle.

Mit freundlicher Genehmigung von Stephen Doster
Sierra Cullati, Kathy Gould und Jun-Song Chen
Die Arbeit wurde von einem Postdoktoranden geleitet Sierra Cullati und in Zusammenarbeit mit einem wissenschaftlichen Assistenzprofessor durchgeführt Jun Song Chen und Wissenschaftler der Goethe-Universität und des Structural Genomics Consortium in Frankfurt, Deutschland, und der Harvard University,
CK1-Enzyme sind eine Familie multifunktionaler Kinasen – Enzyme, die andere Proteine phosphorylieren oder Phosphatgruppen hinzufügen können – die für mehrere Zellfunktionen, einschließlich DNA-Reparatur, Endozytose und mitotische Checkpoint-Signalübertragung, von entscheidender Bedeutung sind. Die Regulation von CK1-Enzymen ist besonders wichtig, da eine Fehlfunktion dieser Enzyme zu verschiedenen Erkrankungen beiträgt, darunter Krebs, neurodegenerative Erkrankungen und Schlafstörungen.
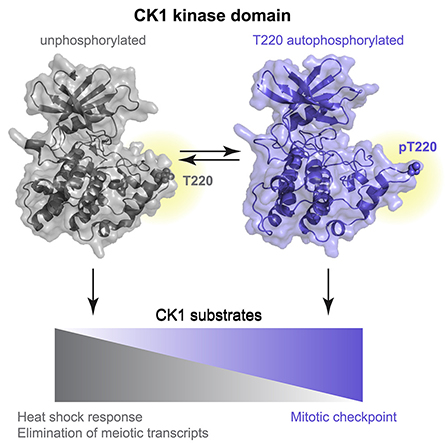
Es gibt sieben CK1-Enzyme in Säugetieren, die unterschiedliche Funktionen ausüben, aber sie sind in ihrer katalytischen Domäne, der Region, die für die Phosphorylierung verantwortlich ist, hochgradig konserviert. Gould und Kollegen fanden heraus, dass ein Mechanismus der CK1-Aktivität und damit ein Regulationsmechanismus die Selbstphosphorylierung eines konservierten Aminosäurerests in seiner katalytischen Domäne ist.
Die Forscher untersuchten weiter, wie diese Selbstphosphorylierung die Aktivität reguliert, und entdeckten, dass die Phosphorylierung an dieser Stelle die Substratspezifität von CK1-Enzymen veränderte. Die Substratspezifität bezieht sich auf die Bestimmung, welche anderen Proteine die CK1-Kinasen phosphorylieren, was wiederum bestimmt, welche Signalwege innerhalb einer Zelle aktiviert werden. Im Allgemeinen steuert der Phosphorylierungszustand von CK1-Enzymen ihre Funktion – oder Dysfunktion – innerhalb einer Zelle. Die Bestimmung, welche Wege durch die phosphorylierten und nicht phosphorylierten Zustände der Enzyme kontrolliert werden, ist ein Schritt zur Entwicklung besserer Behandlungen mit weniger Nebenwirkungen für die durch Enzymdysfunktion verursachten Krankheiten.
Das Gould-Labor und Mitarbeiter hoffen, auf dieser Arbeit aufbauen zu können, indem sie andere Stellen der CK1-Selbstphosphorylierung identifizieren und die von ihnen regulierten Wege untersuchen; Auf einer Seite des Proteins sind beispielsweise mehrere potenzielle Selbstphosphorylierungsstellen gruppiert, die die Forscher faszinieren. Darüber hinaus planen sie zu untersuchen, wie die entdeckten Phosphorylierungsstellen zusammenarbeiten, um eine zusätzliche Kontrolle unter verschiedenen zellulären Bedingungen, wie z. B. zellulärem Stress, bereitzustellen.
Dieser Artikel wurde mit Genehmigung der Vanderbilt School of Medicine neu veröffentlicht. Lesen Sie das Original.

Schöpfer. Hipster-freundlicher Unternehmer. Student. Freundlicher Analyst. Professioneller Schriftsteller. Zombie-Guru. Amateur-Web-Nerd.


















+ There are no comments
Add yours